Secondo la concezione contemporanea, la causa fisica che alla fine produce la sensazione del colore é l'interazione della radiazione luminosa con gli elettroni che costituiscono la materia.
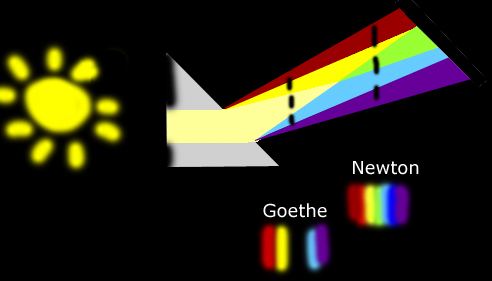
La percezione dei colori é un'esperienza soggettiva nella quale hanno un ruolo importante anche fattori fisiologici e psicologici.Normalmente si assume che il colore percepito sia il risultato di una misura eseguita dall'occhio e di un'interpretazione data dal cervello della composizione spettrale della radiazione osservata.
La luce osservata é una miscela di radiazioni con lunghezza d'onda diversa(frequenza o energia), ma sono sempre i contributi relativi alle diverse radiazioni che determinano il colore percepito.
L'unghezza d'onda, frequenza, energia sono modi diversi di caratterizzare una radiazione luminosa.
L'energia é direttamente proporzionale alla frequenza e queste sono inversamente proporzionali alla lunghezza d'onda.
L'unità di misura della lunghezza d'onda é il nanometro (nm) cioé un miliardesimo di metro.
L'unità di misura dell'energia della radiazione visibile é l' elettronvolt (eV) cioé l'energia acquistata da un elettrone accelerato dalla differenza di potenziale di un Volt.
In termini di lunghezza d'onda lo spettro delle radiazioni visibili é compreso tra i 700 nanometri ( il rosso sfuma nell'ultravioletto ) e circa 400 nanometri ( ai margini della radiazione ultravioletta ).
In termini di energia lo spettro della radia zione é compreso tra 1,77 e 3,1 elettronvolt.
Per la luce vale la Legge Fondamentale della Meccanica Quantistica secondo la quale gli atomi possono esistere solo in stati discreti, ogniuno caratterizzato da un ben determinato livello di energia.I livelli intermedi sono proibiti.Il valore più basso possibile é dello Stato Fondamentale e gli altri livelli, detti Stati Eccitati, si dispongono sopra quello Fondamentale, formando come i gradini di una scala. La distanza di questi gradini é molto variabile.
La luce o qualsiasi altra radiazione può venire assorbita solo se possiede esattamente l'energia necessaria per trasferire l'atomo da un livello ad un altro superiore.
Quando un atomo cade da uno stato eccitato ad uno inferiore, deve emettere una radiazione che porta con sé tutta l'energia che deve perdere nel salto tra i due livelli.
Questa energia si manifesta come fotone o quanto di luce la cui frequenza e lunghezza d'onda sono determinate dalla diferenza di energia tra i due livelli.
Negli atomi, ioni, molecole, ogni elettrone deve occupare un orbitale.Gli orbitali sono organizzati i strati. Ogni gradino della scala delle energie può venire occupato solo da un numero limitato di elettroni: gli strati protagonisti dell'origine dei colori sono i vari, possibili livelli energetici degli elettroni.

| |
|||||||||||

